Složky metabolického syndromu
Obezita
Jedním z klíčových kritérií pro určení přítomnosti MS je obezita a nadváha s centrální distribucí tukové tkáně. Jedná se multifaktoriálně podmíněnou metabolickou chorobu, kdy individuální predispozice vede v případě pozitivní energetické bilance k hromadění tukových zásob. Obezita vzniká při nerovnováze mezi příjmem a výdejem energie. Na jejím rozvoji se podílejí genetické a behaviorální (strava, pohyb, stres) složky. Vyjadřuje se jako index tělesné hmotnosti (BMI), což je orientační měřítko přiměřenosti tělesné hmotnosti a výšky. Vypočte se snadno z tělesné hmotnosti a výšky (BMI (kg/m2) = tělesná hmotnost v kg/(výška v m)2. Za normální se považují hodnoty BMI v rozmezí 18,5 až 25. Samotný BMI však nelze brát jako univerzální ukazatel, protože nic nevypovídá o tělesné stavbě jedince, nezohledňuje distribuci tuku a rozdíl mezi tukovou a netukovou tkání. Vyšší BMI je asociován s vyšší mortalitou (Obr. 11). BMI je také ukazatelem životní prognózy a rizika většiny komplikací obezity.
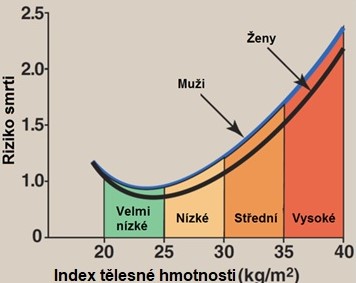
Obr. 11. Vztah BMI a relativního rizika smrti (upraveno z Harvey a Ferrier 2011). Vztah mezi obezitou (vyjádřenou jako BMI) a mortalitou je silnější u osob mladších 55 let, u lidí nad 74 let již tento vztah není.
Tuková tkáň
Tuková tkáň zdravého štíhlého jedince tvoří asi 20 % celkové hmotnosti těla. Obsahuje hlavně triacylglyceroly (TAG) a relativně málo cholesterolu (1-5 mg/g tuku). I syntéza cholesterolu je v tukové tkáni ve srovnání s jinými tkáněmi malá, dosahuje jen asi 5 %. Cholesterol tak pochází zejména z lipoproteinů krve, které jsou do tukové tkáně přijímány prostřednictvím LDL-receptoru a několika typů scavengerových receptorů. Cholesterol se v adipocytech hromadí jednak v plasmatické membráně (zde působí i jako senzor, který reguluje syntézu řady genů), a také na povrchu tukových kapének.
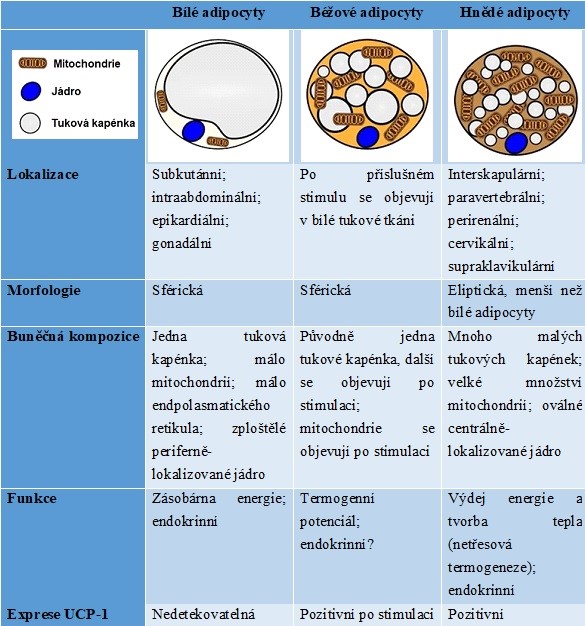
U člověka se vyskytuje bílá a hnědá tuková tkáň, které se od sebe strukturně i funkčně liší (Tab. 2). Bílá tuková buňka obsahuje jednu velkou tukovou vakuolu a malý počet mitochondrií, zatímco hnědé tukové buňky obsahují více malých tukových vakuol a velký počet mitochondrií. Hnědé tukové buňky se svou schopností vydávat energii blíží svalovým buňkám, se kterými mají společný prekurzor. Je možná obousměrná transdiferenciace bílých a hnědých tukových buněk. Množství hnědé tukové tkáně je nejvyšší v pubertě a během dospělosti klesá, negativně rovněž koreluje s nadváhou a obezitou. Významným objevem posledních let je schopnost hnědnutí bílého tuku, tedy konverze bílého tuku na béžový, která souvisí s fyzickou aktivitou. Fyzická aktivita je nejdůležitějším režimovým opatřením v léčbě obezity, protože stimuluje hnědnutí tuku a schopnost tuku zbavit se energie (indukováno irisinem – hormon vylučovaný svalem).
Tabulka
2. Shrnutí hlavních charakteristik bílých, béžových a hnědých adipocytů
(upraveno z El Hadi et al. 2019 a Jung et al. 2019)
Obezita je spojena nejen se zvýšením obsahu tukové tkáně, ale také s významnou změnou její struktury i funkce. Původně se uvádělo, že má tuková tkáň tři funkce – slouží jako mechanická a tepelná ochrana a energetická zásobárna organismu. Tyto role však nevysvětlovaly patogenní působení tukové tkáně u obézních jedinců. To je způsobeno dalšími jevy, které byly u tukové tkáně pozorovány.
Prvním z nich je kapacita tukové tkáně ukládat triacylglyceroly (TAG). Stávající adipocyty se postupně plní TAG a zvětšující tak svoji velikost (hypertrofie). Jakmile je dosaženo jejich maximální velikosti, další možností zvětšení „skladovacích kapacit“ je stimulace zrání a proliferace preadipocytů na zralé adipocyty (hyperplazie) (Obr. 12). Tyto nové, relativně malé buňky dokážou ještě flexibilně reagovat na aktuální potřeby organismu. Obézní jedinci mohou mít až 5x více adipocytů než je normální počet. Při trvající „nadvýživě“ je však tato proliferační kapacita tukové tkáně brzy vyčerpána a další prostor pro skladování lipidů se vytváří zejména zvětšováním stávajících adipocytů (hypertrofií). Takto zvětšené buňky přestávají pružně odpovídat na hormonální signály, a navíc jsou mnohem náchylnější k poškození (prasknutí). Umírající adipocyty (obvyklý biologický poločas adipocytu je 10 let) vytvářejí nekrotická ložiska, která do tukové tkáně přitahují makrofágy a další bílé krvinky a navozující stav chronického zánětu (Obr. 13). Další TAG jsou ukládány ektopicky v jiných orgánech (játrech či svalech), což negativně ovlivňuje jejich funkci. K tomu dochází jak při různých poruchách tvorby tukové tkáně (lipodystrofiích), tak při postupující obezitě. Množství ektopického tuku silně koreluje s insulinovou rezistencí tkání.
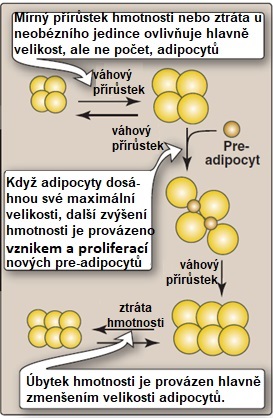
Obr. 12. Hyperplazie a hypertrofie adipocytů probíhající v tukové tkáni obézních jedinců upraveno z Harvey a Ferrier 2011).
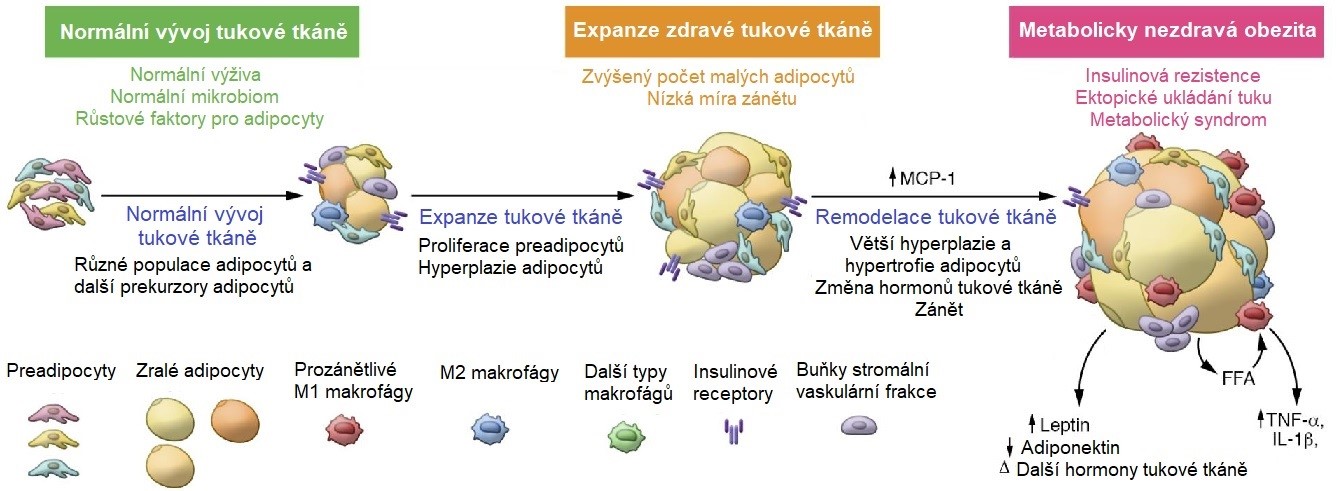
Obr. 13. Schéma přeměny preadipocytů na zralé adipocyty s následnou expanzí tukové tkáně u obézních jedinců (upraveno z Kahn et al. 2019 a Harvey a Ferrier 2011).
Tuková tkáň u obézních jedinců uvolňuje do krevního oběhu velké množství volných mastných kyselin a prozánětlivých molekul, které negativně ovlivňují další orgány. Proto je nejnebezpečnější tzv. abdominální obezita (nahromadění tuku hlavně v břišní dutině), protože jsou portálním systémem ovlivněna přímo játra a slinivka břišní. Lipolýza v tukové tkáni je aktivována katecholaminy, ale též natriuretickými peptidy a TNFα (syntéza v tukové tkáni). Volné mastné kyseliny jsou v buňkách tkání přednostně utilizovány, což vede k inhibici glykolýzy a omezení vstupu glukosy do buňky (Randleův cyklus, viz kapitola Regulace glykemie a její poruchy; diabetes mellitus). Při intracelulární hydrolýze mastných kyselin vzniká 2. posel diacylglycerol, který snižuje aktivitu insulinového receptorového komplexu, což způsobuje snížení citlivosti buněk k insulinu.
Zásadní význam pro objasnění patofyziologického působení tukové tkáně mělo objevení endokrinních vlastností tukové tkáně. Tuková tkáň zdravého (hubeného) člověka produkuje řadu látek proteinové povahy (tzv. adipokiny) bránících projevům MS (adiponektin, visfatin), zatímco u obézních jedinců tvoří celou řadu látek, které mají k MS přímý patogenní vztah (leptin, rezistin). Některé adipokiny mají parakrinní účinky, další jsou secernovány do krve a ovlivňují vzdálené orgány.
Hormony tukové tkáně se dělí na pravé adipokiny a adipokiny v širším slova smyslu. Mezi pravé adipokiny patří látky secernované pouze nebo převážně tukovou tkání. Do této skupiny patří např. IL-6, TNF-α, leptin, rezistin, adiponektin, visfatin, omentin či adipsin. Mezi adipokiny v širším smyslu řadíme PAI-1, CRP, MCP, sérový amyloid A či vaskulární endoteliální růstový faktor.
- Adiponektin - Jedná se o protein (244 AK), jehož receptory jsou exprimovány ve většině tkání. Hladina adiponektinu negativně koreluje s podílem tukové tkáně v organismu, u obézních nalézáme nižší hladiny než u pacientů s normálními hodnotami BMI. Zvyšuje utilizaci a transport glukózy a neesterifikovaných mastných kyselin do svalových, jaterních a tukových buněk. Tyto účinky jsou zajištěny pomocí AMP-kinasy, která při poklesu buněčného ATP obnovuje energetickou rovnováhu v buňce. Také působí antiatherogenně (brání přeměně makrofágů na pěnové buňky, aktivaci endotelových buněk, proliferaci a migraci buněk hladkého svalstva cév a adhezi monocytů na endotel, rovněž zvyšuje syntézu NO buňkami endotelu, a tak působí vasodilatačně). Adiponektin má protizánětlivé účinky. U obézních hladiny adiponektinu klesají a tím je podporována akutní fáze zánětu.
- Leptin - Jedná se o protein (167 aminokyselin), který se podílí na regulaci tělesné hmotnosti (řídí příjem potravy a energetický výdej) prostřednictvím svých receptorů v hypothalamu (inhibuje centrum hladu). Leptin v organismu signalizuje také množství tuku a nutriční zásoby – tzn. že hladina leptinu je přímo úměrná množství zásob tělesného tuku (čím více tukové tkáně, tím více leptinu produkuje). Leptin není fylogeneticky primárně určen k tlumení příjmu potravy, ale k adaptaci organizmu na dlouhodobé hladovění. Pacienti s mutací v genu pro leptin nebo leptinový receptor se fenotypicky manifestují obezitou, dyslipidemií a inzulinovou rezistencí (obr. vlevo dole). Podáváním rekombinantního leptinu pacientům s deficiencí leptinu byly tyto příznaky potlačeny, ovšem u naprosté většiny obézních není tento genetický defekt přítomen a hladina plazmatického leptinu je v normě nebo zvýšená, suplementace rekombinantního leptinu tudíž není efektivní.
- Rezistin - Hormon (108 aminokyselin) syntetizovaný v adipocytech, kosterním svalstvu a imunokompetentních buňkách. Rezistin se zapojuje do hypothalamických okruhů regulace příjmu potravy. Snižuje příjem potravy, reguluje citlivost na insulin, působí jako prozánětlivý cytokin (zvyšuje uvolňování TNF-α, IL-12 a expresi adhezivních molekul). Pravděpodobně se při zvýšené koncentraci může podílet na vzniku inzulinové resistence. Jeho zvýšená hladina pozitivně koreluje s množstvím tukové tkáně. Význam rezistinu se dává do souvislosti s rizikem ATS, podle některých výzkumů zvyšuje hladinu LDL cholesterolu v krvi.
- Visfatin - Hormon produkovaný lymfocyty tukové tkáně (465 aminokyselin), zvyšuje transport glukózy v myocytech, lipogenezi a diferenciaci adipocytů a snižuje produkci glukózy v hepatocytech. Zvýšenou lipogenezí a diferenciací zvyšuje kapacitu viscerálních adipocytů, které tak pojmou více lipidů, které by jinak narušovaly metabolismus ostatních na insulin citlivých tkání.
Regulace energetické rovnováhy organismu
Energetická rovnováha organismu je přísně regulovaný komplexní děj, který je ovlivněn řadou signálů – mechanické z GIT, nutriční (příjem živin), termogenní (vnitřní a vnější teplota) a neurohormonální (integrace signálů v hypothalamu), dále informace o úrovni tukových zásob (leptin a insulin). Cílem regulace příjmu potravy je za fyziologických okolností zajistit rovnováhu mezi příjmem a výdejem energie. Podle uplatnění fyziologických regulačních mechanismů můžeme regulaci příjmu potravy rozdělit na homeostatickou a hedonickou. Homeostatická regulace je řízena fyziologickými mechanismy, faktory orexigenními (zvyšují chuť k jídlu a příjem potravy) a anorexigenními (snižuje chuť k jídlu a snižují příjem potravy). Cílem homeostatické regulace je udržování energetické rovnováhy, stabilní hmotnosti a optimálního příjmu živin. Vedle homeostatické regulace působí i regulace hedonická, při které se uplatňují emoční a motivační vlivy (uspokojení po jídle – smyslové požitky spojené s jídlem). Je do určité míry nadřazena homeostatické regulaci, hlavními mediátory jsou opioidy, endokanabinoidy a dopamin.
Hlavním centrem regulace příjmu potravy a energetické rovnováhy je hypothalamus, centrum sytosti je lokalizováno ve ventromediálním a centrum hladu v laterálním hypothalamu. Klíčovou úlohu v integraci signálů regulujících příjem potravy hraje hypothalamické jádro nucleus arcuatus. Zde se nacházejí 2 subpopulace neuronů regulujících příjem potravy – anorexigenní (snižují příjem potravy) a orexigenní (zvyšují příjem potravy).
Orexigenní neurony produkují agouti-related peptid (AgRP) a neuropeptid Y (NPY), zatímco anorexigenní produkují kokainem a amfetaminem-regulovaný transkript (CART) a proopiomelanokortin (POMC, více v kapitole Poruchy hormonální regulace). Tyto neurony přijímají řadu signálů z periferie, např. leptin, insulin, ghrelin, cholecystokinin (CCK), peptid YY, inkretin GLP-1. Většina hormonů GIT působí anorexigenně, orexigenně působí jen ghrelin a částečně insulin. Orexigenní neurony (NPY/AgRP) jsou aktivovány pomocí ghrelinu a inhibovány prostřednictvím leptinu, insulinu, PYY, cholecystokininu a GLP-1. Anorexigenní neurony (POMC/CART) jsou aktivovány pomocí leptinu a insulinu. Orexigenní neurony (NPY/AgRP) potlačují funkci neuronů anorexigenních (POMC/CART) prostřednictvím receptorů Y1R. Signály obou typů neuronů aktivací či inhibicí receptorů (MC4R, Y1R) ovlivňují neurony v hypothalamických centrech sytosti a hladu (Obr. 14). Tyto neurony společně s neuropřenašeči CNS (adrenergní, dopaminergní, serotoninergní a endokanabinoidní) regulují příjem potravy a výdej energie.
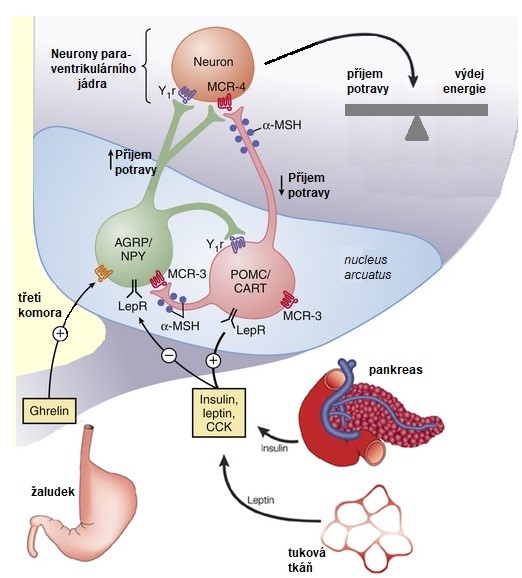
Obr. 14. Regulace energetické homeostázy prostřednictvím neuronů nukleus arcuatus (upraveno z Barsh a Schwartz 2002).
Základní nervové a humorální cesty, které ovlivňují apetit, výdej energie a tělesnou hmotnost zahrnují systémy regulující krátkodobý příjem potravy (regulují velikost jednotlivé porce pomocí pocitu nasycení) a dlouhodobé signály regulace tělesné hmotnosti (spočívá v navození pocitu sytosti a snížení pocitu hladu, ovlivňuje tak frekvenci jednotlivých jídel). Mezi dlouhodobé signály patří leptin a insulin a mezi krátkodobé ghrelin, cholecystokinin, peptid YY a GLP-1.
- Leptin - Hlavní mediátor dlouhodobé regulace příjmu potravy, produkt ob genu. Jedná se o hormon produkovaný v tukové tkáni za fyziologických podmínek úměrně množství tukové tkáně. Leptin je aktivně transportován přes hematoencefalickou bariéru a v hypothalamu ovlivňuje po vazbě na leptinový receptor aktivitu POMC/CART a AgRP/NPY neuronů.
- Insulin - Insulin působí na periferii jako anabolický hormon, zatímco na centrální úrovni působí katabolicky/anorexigenně. Lze ho tedy chápat jako ukazatel množství energetických zásob v tukové tkáni, při zvyšování tukových zásob roste jeho bazální i stimulovaná sekrece, aby byla v prostředí insulinové rezistence udržena homeostáza glukosy. Následná vyšší nabídka insulinu v mozku vede aktivací anorexigenních neuronů ke snížení chuti k jídlu a příjmu potravy.
- Ghrelin - Hormon GIT, který je produkovaný v žaludku (ale také v duodenu, tlustém střevě či hypotalamu). Jeho sekrece je nejvyšší v období lačnění a v ráno, po příjmu potravy sekrece ghrelinu prudce klesá. Hladiny ghrelinu v krvi inverzně korelují s množstvím tukové tkáně. V nucleus arcuatus se váže na GHS receptor 1a (growth hormone secretagogue) a zvyšuje tak expresi orexigenního neuropetidu Y.
- Cholecystokinin, peptid YY, GLP-1 - Produkovány buňkami GIT po jídle. Uplatňují se v procesu trávení a v signalizaci pocitu sytosti. Jejich sekrece vede k zpomalení/inhibici vyprazdňování žaludku a stimulaci pankreatické sekrece. V krátkodobé regulaci příjmu potravy představují signál, který po přenosu do CNS vede k ukončení konzumace jídla. Cholecystokinin spolu se signály z mechanoreceptorů poskytují informaci o roztažení žaludeční stěny. GLP-1 je produkován L-buňkami střeva po jídle. Zvyšuje po jídle sekreci insulinu, snižuje sekreci glukagonu a inhibuje motoriku a sekreční funkce žaludku (viz Poruchy homeostázy glukosy, diabetes mellitus).
Zdravotní rizika spojená s obezitou
Obezita koreluje se zvýšeným rizikem smrti a představuje rizikový faktor celé řady chronických onemocnění, jako jsou diabetes mellitus 2. typu, dyslipidemie, hypertenze, kardiovaskulární onemocnění, některé typy nádorů, žlučníkové kameny, artritida, dna a spánková apnoe.
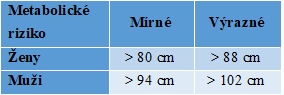
Anatomická distribuce tuku má zásadní vliv na zdravotní rizika spojená s obezitou. Hodnocení rozložení tuku podle poměru pas/boky na typ jablko (abdominální obezita) a typ hruška (gynoidní obezita) je nejdůležitější kvalitativní klasifikací v obezitologii. Riziko metabolických komplikací je úměrné obvodu pasu a obvykle se dělí na mírné a výrazné (Tab. 3). U gynoidního typu obezity (častější u žen) je obvod pasu. resp. poměr pas/boky pod uvedenou dolní hranicí.
Tabulka 3. Metabolické riziko obezity podle obvodu pasu
Kolem 80-90 % tělesného tuku tvoří subkutánní tuková depozita v abdominální oblasti a oblasti stehem a zadku. Dalších 10-20 % představuje viscerální tuk lokalizovaný v dutině břišní kolem orgánů trávicího traktu (Obr. 15). Nadbytek viscerálního tuku a také abdominálního subkutánního tuku zvyšuje metabolická a zdravotní rizika spojená s obezitou.
Adipocyty z různých oblastí těla se liší biochemickou aktivitou. Adipocyty z dolní části těla (hýždě a stehna) jsou zejména u žen větší a velmi efektivní ve skladování tuků, ale jejich spalování a mobilizace mastných kyselin je pomalejší ve srovnání se subkutánními adipocyty v abdominální oblasti. Viscerální adipocyty mají nejvyšší metabolickou aktivitu. V tukových depozitech obézních pacientů (viscerální a subkutánní adipocyty v abdominální oblasti) je vysoká míra lipolýzy přispívající ke zvýšené dostupnosti volných mastných kyselin. Tyto metabolické rozdíly mohou vysvětlovat zvýšené zdravotní riziko u osob s obezitou v horní části těla.
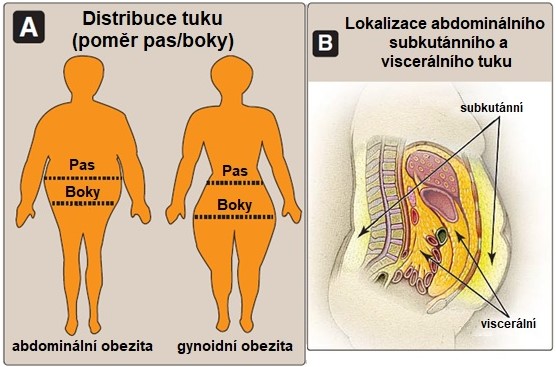
Obr. 15. Anatomická distribuce tuku (A), lokalizace tukových depozit v dutině břišní (B) (upraveno z Harvey a Ferrier 2011).
Dyslipoproteinemie
U metabolického syndromu se vyskytují tři klasické změny lipidových parametrů: vysoká hladina TAG (resp. VLDL), nízká hladina HDL-cholesterolu a přítomnost sdLDL, které jsou vysoce atherogenní. Dále dochází k nízkému vstřebávání cholesterolu z potravy a jeho zvýšené endogenní syntézy. Zvýšení koncentrace celkového a LDL-cholesterolu k dyslipidemii metabolického syndromu sice z patogenetického hlediska nepatří, přesto je ale – vzhledem k vysokému výskytu v populaci – nacházíme u osob s metabolickým syndromem velmi často. Vliv obezity a metabolického syndromu na plasmatické hladiny cholesterolu, TAG a HDL-cholesterolu jsou shrnuty v Obr. 16.
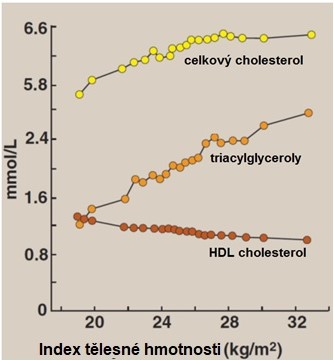
Obr. 16. Vztah indexu tělesné hmotnosti a hladin krevních lipidů (upraveno z Harvey a Ferrier 2011).
V léčbě metabolického syndromu se uplatňují léčiva snižující hladiny celkového a LDL-cholesterolu (statiny) a snižující hladiny TAG a zvyšující hladiny HDL-cholesterolu (fibráty). Léčba statiny významně snižuje kardiovaskulární riziko u pacientů s metabolickým syndromem. U mnoha nemocných s metabolickým syndromem se však monoterapií nedaří dosáhnout normálních hodnot krevních lipidů. Při současném zvýšení LDL-cholesterolu, TAG a snížení HDL-cholesterolu se často přistupuje ke kombinační terapii statinů s fibráty fibráty, která je velmi účinná.
Hypertenze
Společným rizikovým faktorem pro vznik arteriální hypertenze, hyperlipidemie a diabetu mellitu 2. typu je insulinová rezistence. Insulinová rezistence se na vzniku arteriální hypertenze u metabolického syndromu podílí několika mechanismy: nadměrná aktivace sympatického nervového systému; aktivace systému renin-angiotenzin-aldosteron s následnou retencí Na a zvýšením objemu; dysfunkcí endotelu a změnami ve funkci ledvin.
V ledvinách se zvyšuje tubulární resorpce Na+ v důsledku snížené aktivity Na/K-ATPasy, zvýšené aktivity Na/H-ATPasy a výměny Na+ za Mg2+ (intracelulární hladina Na+ je trojnásobně zvýšená). Zvýšení koncentrace Na+ a Cl- iontů v ledvinách způsobí zvýšení syntézy reninu vedoucí k aktivaci systému renin-angiotenzin-aldosteron a k aktivaci sympatiku.
U hypertoniků je intracelulární obsah vápníku v neutrofilech a erytrocytech zvýšený a koreluje s plazmatickými hladinami insulinu a krevním tlakem. Intracelulární vápník ovlivňuje membrány těchto i dalších buněk, což může být příčinou změn reologických vlastností krve v mikrocirkulaci. Insulin a obsah intracelulárního kalcia se tak u hypertenze podílí na rozvoji cévního postižení.
V patogenezi hypertenze u metabolického syndromu hraje významnou roli aktivace sympatiku. Dlouhodobé zvýšení plasmatických hladin katecholaminů je příčinou biochemických změn, které vedou k insulinorezistenci a glukózové intoleranci. Aktivace sympatiku vede k uvolnění reninu v ledvinách, a tím zasahuje do systému renin-angiotenzin-aldosteron. Navíc angiotensin II stimuluje aktivitu sympatiku na centrální i periferní úrovni. Zvýšená aktivita sympatiku vede ke zvýšené produkci angiotensinu II, a ten dále zvyšuje aktivitu sympatiku – vzniká tak bludný kruh.
U metabolického syndromu s insulinovou rezistencí byla popsána porušená vazodilatace arteriálního řečiště a kapilár, což souvisí se sníženou produkcí vasodilatačních prostaglandinů (PGE2 a PGI2). Vasodilataci působí stimulací syntézy oxidu dusnatého a jsou antagonisty vasokonstrikčně působících eikosanoidů (TxA2).
Porucha homeostázy glukosy
Metabolický syndrom je spojený s diabetem mellitem 2. typu a insulinorezistencí, což ve výsledku vede k poruše regulace glykemie. K insulinorezistenci přispívá několik patogenetických mechanismů. U obézních pacientů s diabetem mellitem 2. typu je zvýšená oxidace lipidů, hladiny volných mastných kyselin jsou zvýšené a klesá schopnost využití glukosy tkáněmi (Randleův cyklus). Volné mastné kyseliny působí tzv. lipotoxicitu v β‑buňkách pankreatu a díky tomu postupně klesá produkce insulinu a prohlubuje se insulinová rezistence tkání.