Přehled transportu a intracelulárního metabolismu glukosy
Transport glukosy přes membrány
D-glukosa je nejvýznamnějším přirozeně se vyskytujícím monosacharidem, který slouží jako hlavní zdroj energie pro buňky a tkáně. Molekuly glukosy jsou silně polární a nemohou tedy prostupovat hydrofobní lipidovou dvojvrstvou membrány prostou difuzí, proto během evoluce vznikly transportní mechanismy umožňující přenos glukosy (i dalších hydrofilních látek) přes buněčné membrány. Do současné doby byly identifikovány dvě rodiny glukosových transportérů – přenašeče zprostředkovávající usnadněnou difuzi (GLUT, glucose transporters) a transportéry zajišťující aktivní transport (SGLT, sodium-dependent glucose transporters). Nejrozšířenějším způsobem transportu glukosy je usnadněná difuze, zatímco aktivní transport zprostředkovaný transportéry SGLT probíhá zejména v enterocytech a buňkách proximálních tubulů ledvin. Dosud bylo nalezeno a popsáno 14 různých přenašečů GLUT a 6 transportérů SGLT. Charakteristiky nejvýznamnějších transportérů jsou uvedeny v Tabulce 1.
Tabulka 1. Hlavní transportní systémy pro aktivní (SGLT) a pasivní (GLUT) transport glukosy přes buněčnou membránu
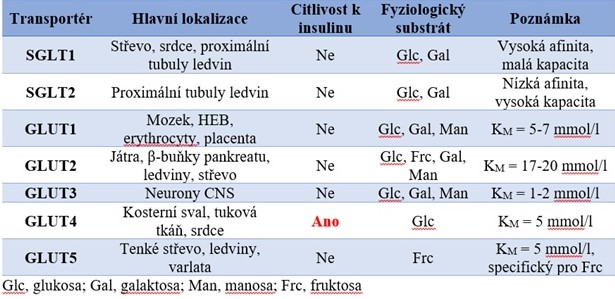
Při usnadněné difuzi probíhá transport po koncentračním gradientu do místa s nižší koncentrací transportované látky. Rychlost transportu závisí na afinitě transportéru k substrátu (hodnota KM) a také na koncentraci substrátu. Pokud je hodnota KM výrazně nižší, než koncentrace glukosy v extracelulární tekutině, pak se rychlost transportu glukosy do buňky výrazně nezmění ani při značných změnách glykemie. Transportér GLUT3 je vysokoafinitní přenašeč (KM = 1-2 mmol/l), který zajišťuje konstantní přísun glukosy do neuronů CNS, i když hladiny glukosy v extracelulární tekutině kolísají (příjem potravy, fyzická zátěž atd.). Naproti tomu vysoká hodnota KM značí, že rychlost transportu glukosy bude závislá na její koncentraci (čím vyšší bude koncentrace glukosy, tím rychleji bude transportována do buněk). Jaterní buňky a β-buňky Langerhansových ostrůvků exprimují vysokokapacitní a nízkoafinitní přenašeč GLUT2 (KM = 15-20 mmol/l), který umožňuje jaterním buňkám hromadit glukosu po příjmu potravy bohaté na sacharidy a β-buňkám zvyšovat sekreci insulinu úměrně se vzestupem glykemie. Hustota transportérů a schopnost zpracovávat glukosu je v některých tkáních regulována pomocí insulinu. Tyto tkáně (např. kosterní svaly, tuková tkáň) exprimují transportér GLUT4, který je přítomný uvnitř buňky v cytoplasmatických vesikulech a na povrch buňky se dostává až po navázání insulinu na receptor na povrchu buňky. Takto se zvyšuje počet transportérů na povrchu buňky i kapacita buňky vychytávat glukosu z extracelulárního prostoru. Je pravděpodobné, že insulin zvyšuje prostřednictvím fosforylace rovněž aktivitu a kapacitu transportérů GLUT4. Po poklesu glykemie je insulin z receptoru odstraněn a transportéry GLUT4 jsou endocytosou odstraněny z plasmatické membrány a uskladněny uvnitř buňky ve vesikulech.
Aktivní transportní systémy SGLT využívají pro přenos glukosy koncentrační gradient sodíku mezi extracelulární a intracelulární tekutinou vytvořený iontovou pumpou Na+,K+-ATPasou. Transportéry SGLT aktivně vychytávají glukosu proti koncentračnímu gradientu a tím umožňují dosáhnout prakticky nulových koncentrací glukosy v lumen tenkého střeva a v proximálních tubulech ledvin.
Přenos glukosy přes membránu je komplexně regulovaný systém a exprese různých transportérů v jednotlivých typech buněk se významně podílí na regulaci metabolismu cukrů. Buňky mohou současně exprimovat několik transportních systémů. Příkladem mohou být enterocyty a proximální tubuly ledvin, které exprimují odlišné transportéry na luminální a bazolaterální membráně a zajišťují tak jednosměrný přenos glukosy do krve (Obr. 1).
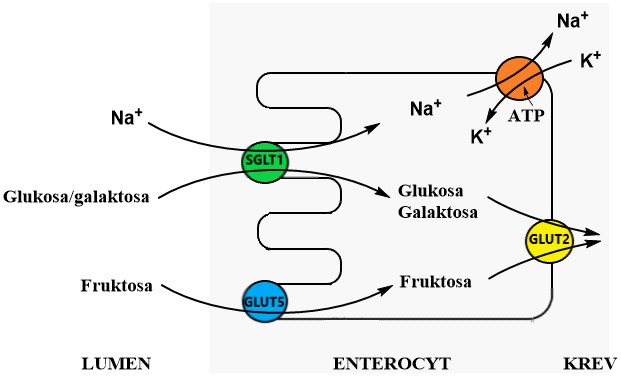
Obr. 1. Přenos cukrů pomocí transportérů SGLT a GLUT stěnou enterocytů do krve
Intracelulární metabolismus glukosy
Usnadněná difuze zprostředkovaná některým z transportérů GLUT představuje nejběžnější způsob přenosu glukosy přes cytoplasmatickou membránu. K zajištění plynulosti tohoto přenosu jsou nutné mechanismy, které vytvářejí koncentrační gradient glukosy mezi extra- a intracelulárním prostředím. V případě hepatocytu je po příjmu potravy nezbytné, aby se glukosa uvnitř buňky rychle metabolizovala, protože pokud by se glukosa uvnitř hepatocytu hromadila, nebyl by přenos dalších molekul glukosy do buňky možný. Naopak v případě hladovění je nutné, aby intracelulární koncentrace glukosy v hepatocytu stoupla nad koncentraci v extracelulárním prostoru, a mohlo tak dojít k jejímu transportu do krve. Mechanismy zajišťující koncentrační gradient glukosy mezi extra- a intracelulárním prostředím jsou dány na jedné straně aktivitou enzymů/drah, které hladinu glukosy snižují (hexokinasa/glukokinasa, glykolýza, syntéza glykogenu), a na druhé straně aktivitou enzymů/drah, které hladinu glukosy zvyšují (glukosa-6-fosfatasa, glukoneogeneze, glykogenolýza).
Hexokinasa a glukokinasa přeměňují glukosu na glukosa-6-fosfát, který je výchozím substrátem glykolýzy i syntézy glykogenu. Tyto enzymy se liší svou regulací, hodnotou KM a lokalizací. Glukokinasa (též hexokinasa typu IV) je přítomná zejména v játrech, β-buňkách pankreatu, mozku a GIT, tedy v tkáních, které se významně podílejí na udržení stálé koncentrace glukosy v krvi. V těchto tkáních působí jako glukosový sensor. Glukokinasa se uplatňuje po příjmu potravy bohaté na sacharidy, kdy se podílí na odstraňování přebytku glukosy z krevního oběhu. Má vysokou hodnotu KM (~ 12 mmol/l) a její aktivita není zpětnovazebně regulována glukosa-6-fosfátem. Fosforylace glukosy glukokinasou vyvolá v játrech syntézu glykogenu a uvolnění insulinu z β-buněk pankreatu. Transkripce a translace glukokinasy je indukována insulinem. Hexokinasa má nízké KM pro glukosu (~ 0,05 mmol/l) a je inhibována glukosa-6-fosfát. Za normálních podmínek je tento enzym nasycen substrátem a tak může zajišťovat konstantní rychlost dostupnosti glukosa-6-fosfátu pro potřeby buněk. Hexokinasa je schopná fosforylovat i další hexosy (např. fruktosu a manosu), ale s menší afinitou než je tomu v případě glukosy (Obr. 2).
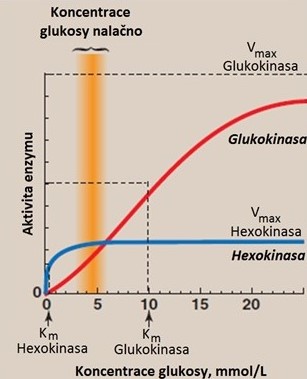
Obr. 2. Vliv koncentrace glukosy na rychlost její fosforylace katalyzované hexokinasou a glukokinasou (upraveno z Harvey a Ferrier 2011)
Přeměna glukosa-6-fosfátu na glukosu je katalyzována glukosa-6-fosfatasou, enzymem specifickým pro játra (v menší míře je přítomná též v ledvinách a enterocytech). Hodnota KM tohoto enzymu je dostatečně vysoká, aby umožnila zvyšovat tvorbu glukosy úměrně nabídce glukosa-6-fosfátu. Při hladovění a tělesné zátěži dochází díky působení glukagonu, katecholaminů a kortisolu a díky sníženému účinku insulinu k aktivaci glykogenolýzy a glukoneogeneze a je inhibováno využití glukosa-6-fosfátu v glykolýze a glykogenezi. Díky tomu roste v hepatocytu nabídka glukosa-6-fosfátu, stoupá rovněž syntéza glukosy de novo a její uvolňování do krve.
Shrnutí glykolýzy a glukoneogeneze je uvedeno v Obr. 3.
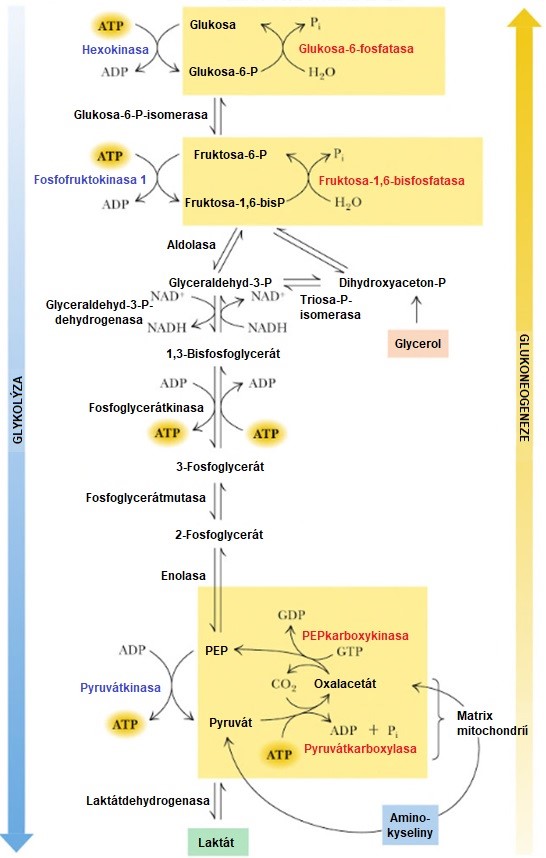
Obr. 3. Srovnání glykolýzy a glukoneogeneze (upraveno z Garrett a Grisham 2010). Modře psané enzymy jsou specifické pro glykolýzu, červeně pro glukoneogenezi a černě jsou společné pro obě dráhy. Ve žlutých boxech jsou uvedeny reakce, které se mezi oběma drahami liší. PEP, fosfoenolpyruvát
Využití glukosy v jednotlivých tkáních
Různé typy buněk metabolizují glukosu odlišným způsobem. V erytrocytech (Obr. 4a) je glukosa po svém vstupu do buňky, který je zprostředkován transportérem GLUT1, metabolizována převážně anaerobní glykolýzou. Erytrocyty nemají mitochondrie, proto je glukosa kontinuálně metabolizována na laktát, který je vylučován do krve. Glukosa vstupující do pentosového cyklu poskytuje NADPH nezbytné pro udržení glutathionu v redukované formě, který se významně podílí na ochraně membrán erytrocytů před poškozením organickými peroxidy a peroxidem vodíku. Do buněk mozku (Obr. 4b) je glukosa transportována pomocí GLUT1 a GLUT3, následně podléhá glykolýze za vzniku pyruvátu, který je pak v mitochondriích oxidován až na CO2 a H2O. V těchto buňkách je rovněž aktivní pentosový cyklus produkující NADPH, které je využito pro redukční biosyntézy a pro udržení glutathionu v redukovaném stavu. Vstup glukosy do kosterních svalů a myokardu (Obr. 4c) je stimulován insulinem a zprostředkován transportérem GLUT4. Glukosa je zpracována v glykolýze a vznikající pyruvát je za aerobních podmínek oxidován až na CO2 a H2O za vzniku ATP. V nepřítomnosti kyslíku je pyruvát redukován na laktát, který je vyloučen do krve. Svalové buňky dokáží syntetizovat značné množství glykogenu. Adipocyty (Obr. 4d) jsou rovněž vybaveny transportérem GLUT4. Glukosa je v těchto buňkách glykolýzou přeměněna na pyruvát, který je v pyruvátdehydrogenasovém komplexu oxidován na acetyl-CoA, který je primárně použit k de novo syntéze mastných kyselin. NADPH, které je pro biosyntézu mastných kyselin nezbytné, vzniká v pentosovém cyklu. Adipocyty jsou schopné syntetizovat a odbourávat glykogen, ale tyto procesy jsou ve srovnání se svalovými buňkami nebo játry značně omezené. Buňky jaterního parenchymu (Obr. 4e) disponují nejširším spektrem metabolických drah zpracovávajících glukosu. Ta je do jaterních buněk transportována nízkoafinitním, vysokokapacitním transportérem GLUT2. Glukosa podstupuje extenzivní metabolismus v pentosovém cyklu, jehož produkt NADPH je použit k redukčním biosyntézám, redukci oxidovaného glutathionu a k celé řadě reakcí katalyzovaných enzymy endoplasmatického retikula. Další produkt pentosového cyklu ribosa-5-fosfát slouží k syntéze nukleotidů (ATP, DNA, RNA). Glukosa je v játrech uložena ve formě glykogenu. Další důležitou funkcí jater je detoxikace xenobiotik a některých eobiotik (např. bilirubin), která jsou konjugována s kyselinou glukuronovou, vznikající oxidací glukosy. Pyruvát vznikající v glykolýze je po oxidaci na acetyl-CoA buď kompletně oxidován v citrátovém cyklu, nebo je použit pro de novo syntézu mastných kyselin. Jedinečnou schopností jaterních buněk je přeměna tříuhlíkatých prekurzorů (např. laktát, pyruvát, glycerol, alanin) na glukosu v glukoneogenezi a její uvolnění do krve.
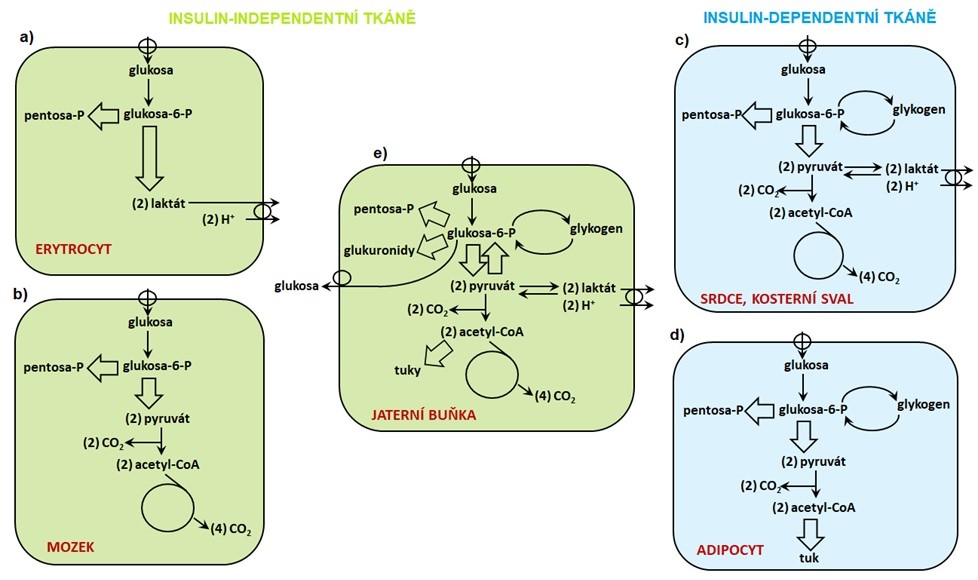
Obr. 4. Přehled hlavních cest intracelulárního metabolismu glukosy ve vybraných tkáních těla (upraveno z Devlin 1997).