Syntéza hemu
Biosyntéza hemu probíhá ve všech buňkách lidského těla. Nejvýraznější je v erytroidních buňkách kostní dřeně (70-80 %) a buňkách jater. Hem v prekurzorech erytrocytů se stává součástí hemoglobinu. V játrech je vestavován do enzymů z rodiny cytochromů P450 a v buňkách ostatních tkání je součástí dalších enzymů, uvedených v předchozím přehledu.
Syntéza hemu vychází z aminokyseliny glycinu a sukcinylkoenzymu A. Zdrojem sukcinylCoA je vedle kyseliny glutamové cyklus trikarboxylových kyselin, proto se snadno pamatuje, že tato syntéza začíná v mitochondriích. Již první krok celého syntetického řetězce je klíčový a je katalyzován enzymem 5-aminolevulátsynthasou (ALA-synthasou), která spolupracuje s koenzymem pyridoxal-5‘-fosfátem. ALA-synthasa je limitujícím a zároveň regulatorním enzymem celé syntézy hemu (Obr. 1).
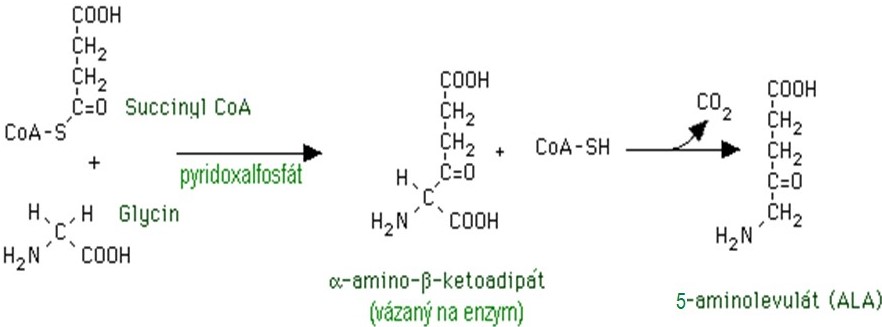
Obr. 1. Syntéza kyseliny 5-aminolevulové, katalyzovaná ALA-synthasou (upraveno z Baggott a Dennis 1995).
Kyselina 5-aminolevulová se tvoří z výchozích látek v mitochondriální matrix. ALA může také být importována z extracelulárního prostoru do cytoplasmy cílových buněk pomocí oligopeptidových transportérů PEPT1 nebo PEPT2.
ALA je postupně přeměněna na koproporfyrinogen III za katalytické účasti 4 enzymů. Koproporfyrinogen III je pak transportován zpět do mitochondrie (nejdříve do mezimembránového prostoru) pomocí transportéru ABCB6, a je přeměněn na protoporfyrinogen za katalýzy koproporfyrinogen-III-oxidasou. Vzniklý protoporfyrinogen je pak oxidován protoporfyrinogenoxidasou na protoporfyrin IX (III). Protoporfyrin je transportován do matrix a současně obohacen o Fe2+ za katalýzy ferrochelatasou. Syntetizované molekuly hemu jsou z mitochondrie exportovány transportérem FLVCR1b (Feline leukemia virus subgroup C receptor-related protein 1b). V obrázku 2 je také naznačena degradace hemu mikrosomální hemoxygenasou 1 na biliverdin a následně biliverdinreduktasou na bilirubin, což bude popsáno dále v kapitole o katabolismu hemu. Hem indukuje hemoxygenasu, která degraduje nadbytek nově syntetizovaného hemu na žlučová barviva. Odstranění přebytečného hemu je jedním z regulačních mechanismů jeho koncentrace. Intracelulární homeostáza porfyrinů je také udržována exportem přes plasmatickou membránu za účasti transportéru ABCG2 (Obr. 2).
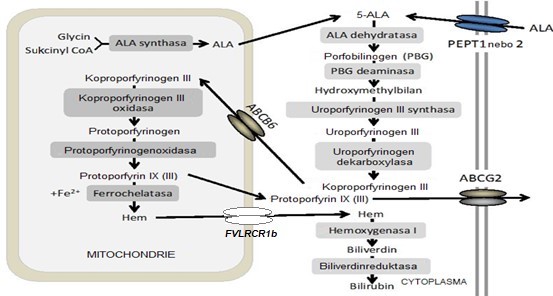
Obr. 2. Biosyntéza hemu a transport meziproduktů (upraveno z Teng et al. 2013).
K syntéze jedné molekuly porfobilinogenu jsou potřeba 2 molekuly ALA za katalýzy ALA-dehydratasou (Obr. 3).
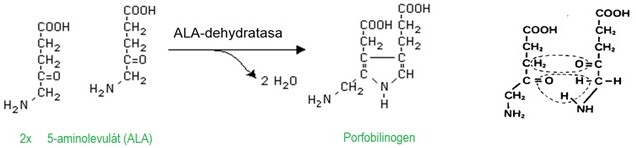
Obr. 3. Syntéza porfobilinogenu (Murray et al. 1998)
V dalším kroku se spojí 4 porfobilinogeny do jediné molekuly uroporfyrinogenu. Teoreticky by mohly vzniknout 4 isomery uroporfyrinogenu, v organismu však vznikají pouze dva (Obr. 4). Z katalýzy enzymem porfobilinogendeaminasou vzniká nejdříve lineární hydroxymethylbilan. Ten se může spontánně přeměnit na uroporfyrinogen I, který je nepotřebným vedlejším produktem. Jediným prekurzorem hemu je uroporfyrinogen III, k jehož vzniku je potřeba spolupráce s dalším proteinem, kterým je uroporfyrinogen-III-kosynthasa.
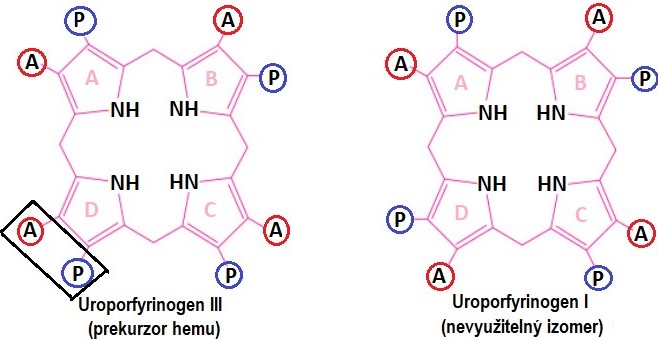
Obr. 4. Struktura uroporfyrinogenů. A = acetát, P = propionát (viz struktura porfobilinogenu) (vytvořeno podle různých zdrojů).
Jak je zřejmé z Obr. 5, nomenklatura molekul, zajišťujících vznik uroporfyrinogenů, není jednotná. Např. protein spolupracující při tvorbě uroporfyrinogenu III je někde označován jako enzym (synthasa), jinde jako kosynthasa. Pro pochopení poruch syntézy hemu je však důležité vědět, jak se od sebe tvorba uroporfyrinogenu III a uroporfyrinogenu I liší a jaký je význam tohoto kroku.
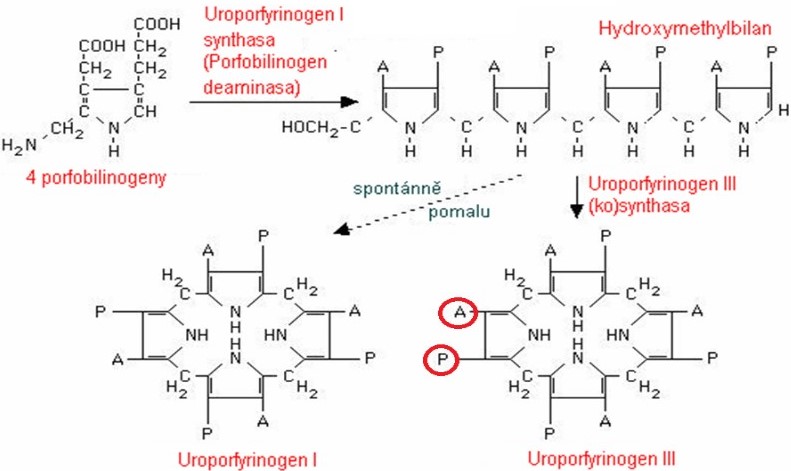
Obr. 5. Syntéza uroporfyrinogenů (Murray et al. 1998)
Uroporfyrinogen III je na cestě syntézy hemu dále přeměněn na koproporfyrinogen III. Reakce je katalyzována uroporfyrinogendekarboxylasou. Ačkoliv je uroporfyrinogen I ve srovnání s uroporfyrinogenem III neužitečným produktem, je rovněž substrátem uroporfyrinogendekarboxylasy a může být přeměněn na další produkt, koproporfyrinogen I (Obr. 6).
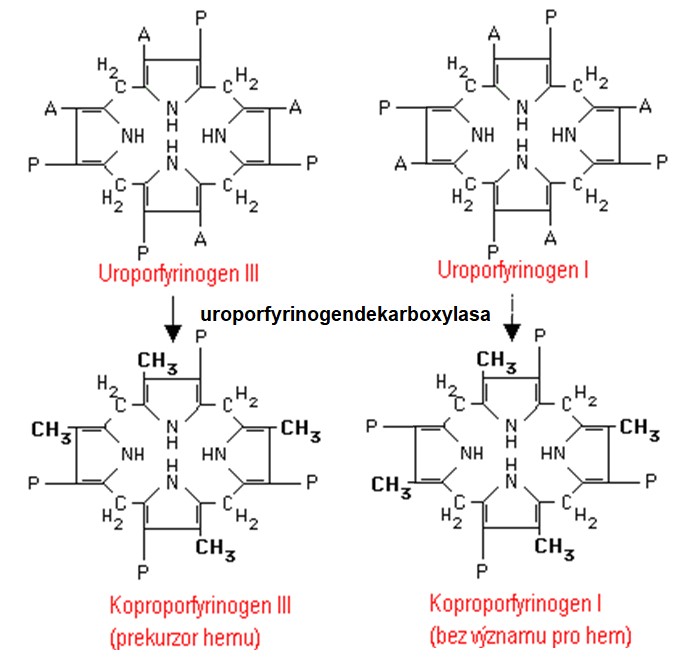
Obr. 6. Tvorba koproporfyrinogenů. Všechny čtyři acetátové skupiny jsou dekarboxylovány za vzniku methylů (Murray et al. 1998).
Koproporfyrinogen III je transportován do mitochondrie, kde se odehrávají další kroky syntézy hemu. V mitochondrii je koproporfyrinogen III přeměněn na protoporfyrinogen IX (někdy je označován jako protoporfyrinogen III) (Obr. 7). Reakce je katalyzována koproporfyrinogen-III-oxidasou. V tomto kroku již není přeměňován koproporfyrinogen I.
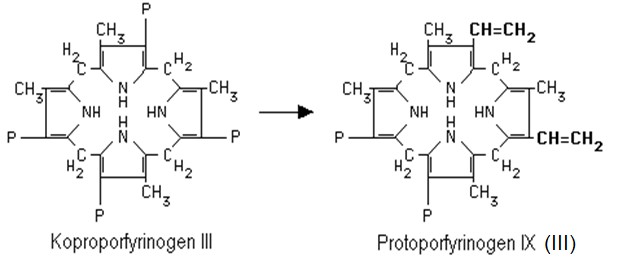
Obr. 7. Vznik protoporfyrinogenu. Oxidativní dekarboxylací jsou přeměněny 2 zbytky kyseliny propionové na vinyly, další 2 propionáty se nemění (Murray et al. 1998).
Protoporfyrinogen IX se v dalším kroku mění na protoporfyrin (Obr. 8). Jde o zásadní změnu struktury a vlastností, protože systém izolovaných dvojných vazeb jednotlivých pyrrolových jader se přeměňuje na konjugovaný systém celé molekuly porfyrinu. Platí obecně, že porfyriny jsou na rozdíl od bezbarvých porfyrinogenů barevné v různých odstínech červeně. Zbarvení je dáno systémem konjugovaných dvojných vazeb v jejich molekule, které absorbují viditelné světlo a v UV světle červeně fluoreskují.
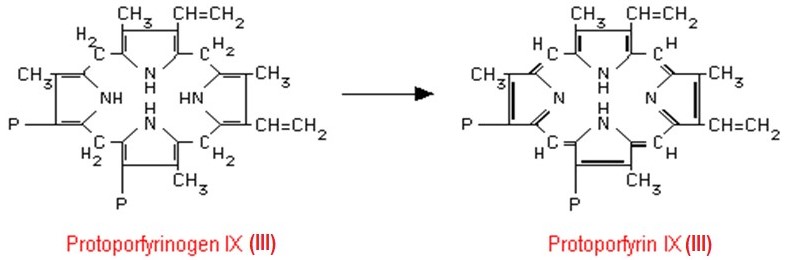
Obr. 8. Vznik protoporfyrinu IX (III) za katalýzy mitochondriální protoporfyrinogenoxidasou (Murray et al. 1998).
Posledním krokem syntézy hemu je vnesení kationtu Fe2+, které je katalyzováno enzymem ferrochelatasou (hemsynthasou) (Obr. 9).
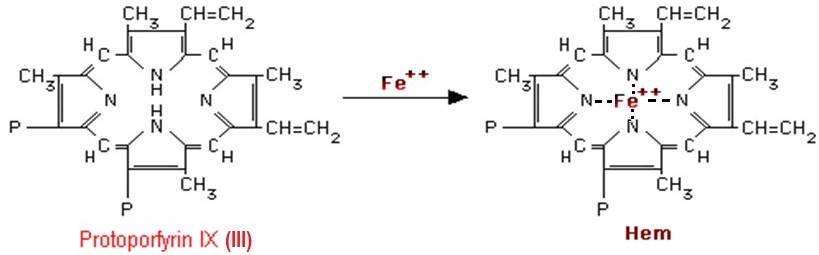
Obr. 9. Vnesení Fe2+ do molekuly protoporfyrinu za vzniku hemu (Murray et al. 1998).
Porfyriny váží svůj centrální atom kovu čtyřmi N atomy v pyrrolových jádrech. Železo však preferuje vazbu s více než čtyřmi ligandy, a další dva ligandy se tak mohou vázat kolmo na rovinu cyklu. V případě hemoglobinu je páté místo vázáno na zbytek His globinového řetězce a poslední (šesté) může být obsazeno molekulou O2. Iont Fe2+ má tedy v molekule hemu celkem 6 koordinačně kovalentních vazeb.
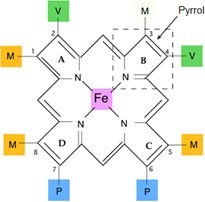
Obr. 10. Struktura hemu (upraveno z Memorangapp.com 2019)
Regulace syntézy hemu
ALA-synthasa je klíčovým regulatorním enzymem syntézy hemu, závislým na pyridoxalfosfátu. Rozlišuje se ALA synthasa 1, která je v přítomna v hepatocytech, a ALA synthasa 2 v erytroidních buňkách.
Regulace jaterní ALA synthasy (ALAS 1)
Tento isoenzym je inhibován hemem a hematinem, což je typický zpětnovazebný mechanismus, regulující syntézu konečného produktu hned na začátku syntetické dráhy, čímž se omezí tvorba meziproduktů (Obr. 11). Regulace se děje na úrovni transkripce, translace mRNA, přesunu molekuly ALA synthasy do mitochondrie i přímé allosterické inhibice enzymu hemem (Obr. 12).
Významným regulačním mechanizmem syntézy hemu v játrech je rychlý obrat ALAS. Biologický poločas ALAS činí přibližně 70 min, což je nejméně ze všech známých mitochondriálních proteinů.
Opačný účinek na ALA synthasu mají některá léčiva, která tento enzym indukují (některé steroidy, barbituráty aj.)
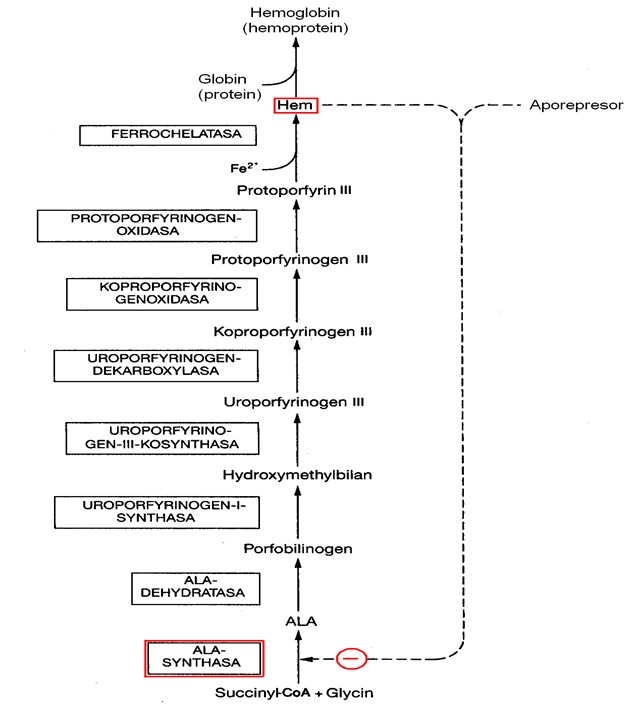
Obr. 11. zpětnovazebná regulace jaterní ALA synthasy konečným produktem syntézy hemu (upraveno z Murray et al. 1998)
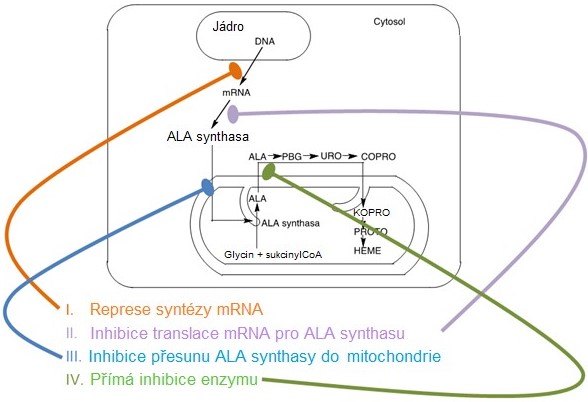
Obr. 12. Regulace jaterní ALA-synthasy 1 hemem (upraveno z Memorangapp.com 2019)
Regulace ALA-synthasa erytroblastů (ALAS 2)
ALA synthasa erytroidních tkání není inhibována hemem ani není indukována léky. Základní regulace ALAS2 se děje na úrovni dostupnosti železa (ovlivnění translace). Hem moduluje dostupnost železa tím, že inhibuje transport železa z transferinu do cytosolu (Obr. 13).
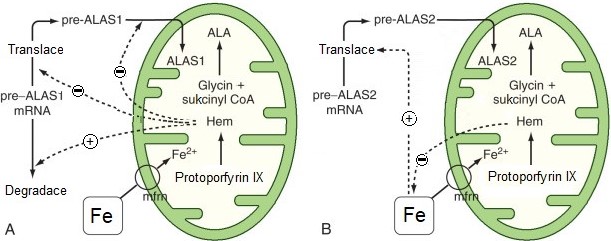
Obr. 13. Srovnání regulace jaterní ALAS1 hemem (A) a regulace erytroidní ALAS2 dostupností železa (B) (upraveno z Fuller a Wiley 2018).