Vybrané rizikové faktory ATS
Lipoprotein(a)
Lipoprotein(a) (Lp(a)) je samostatným rizikovým faktorem ATS (viz. kapitola 8). Lp(a) je složený z LDL částice, na jejíž apoB-100 je prostřednictvím disulfidického můstku připojen apolipoprotein(a). Apo(a) není strukturně podobný ostatním apolipoproteinům. Jedná se o vysoce polymorfní glykoprotein s molekulovou hmotností 300-800 kDa, jehož základní strukturní jednotkou je doména, která se skládá z asi 80 aminokyselin a má tvar trojité smyčky, která je stabilizovaná třemi vnitřními disulfidickými můstky. Díky tomu má tato doména tvar připomínající dánský preclík („kringle“), odtud také pochází přívlastek „kringlová“ (též „preclíková“) doména. Apo(a) obsahuje dva typy kringlů – typ IV a typ V, které se podobají kringlovým doménám plasminogenu (ten má na rozdíl od apo(a) ve své struktuře pět typů kringlových domén). Variabilita ve velikosti apo(a) je způsobena různým počtem kringlových domén typu IV, jejichž počet je dán geneticky a mohou se vyskytovat v počtu 1 až více než 40 (Obr. 9). Plasminogen i apo(a) mají proteasovou doménu, ale u apo(a) je v aktivním místě zaměněn Ser za Arg a díky této záměně je apo(a) nefunkčním strukturním homologem plasminogenu.
Variabilní velikost apo(a) způsobuje heterogenitu velikosti a hustoty Lp(a) a souvisí s plasmatickými hladinami Lp(a). V lidské populaci bylo zatím identifikováno více než 40 různých isoforem Lp(a) a tedy více než 40 různých velikostí Lp(a). Mezi velikostí apo(a), která je dána počtem kringlu IV, a plasmatickými hladinami Lp(a) existuje inverzní vztah. Přítomnost malých isoforem apo(a) v krvi je provázena vysokými hladinami Lp(a) a naopak. U jednoho člověka se vyskytují maximálně dvě isoformy apo(a), protože molekulová hmotnost apo(a) je určována dvěma alelami.
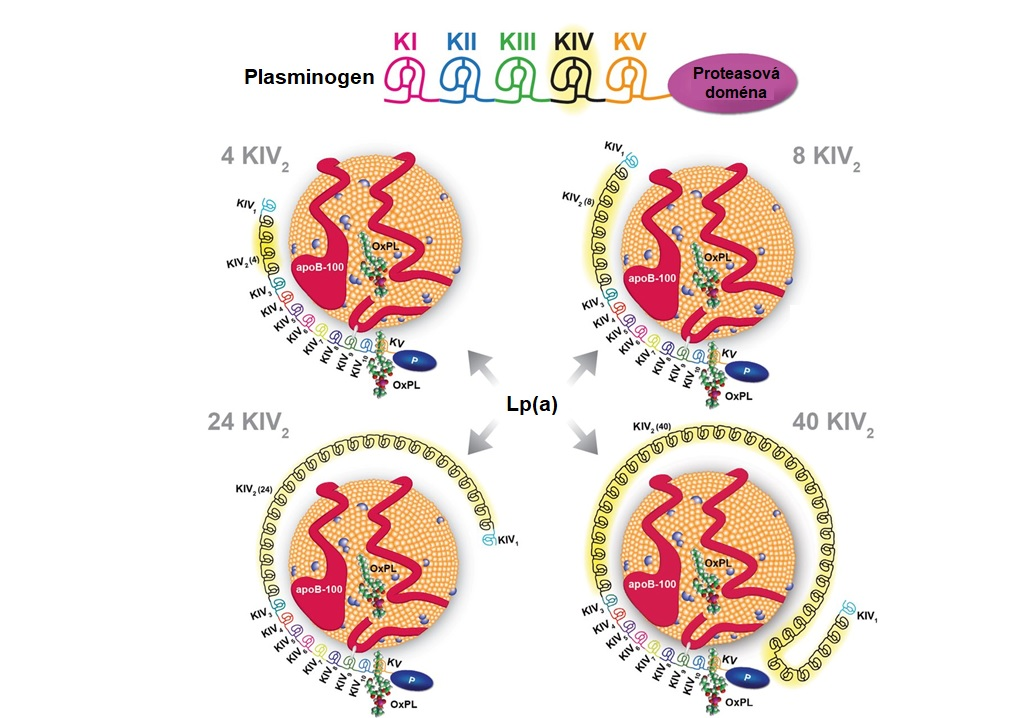
Obr. 9 Struktura Lp(a) a jeho podobnost s plasminogenem (upraveno z Tsimikas 2017). Plasminogen má 1 kopii každé kringlové domény (KI-V) a aktivní proteasovou doménu, zatímco apo(a) obsahuje 10 podtypů kringlu IV (1 kopie od KIV1 a KIV3-10, více kopií KIV2), 1 kopii kringlu V a neaktivní proteasovou doménu (P). Na obrázku jsou příklady isoforem apo(a) obsahující 4, 8, 24 a 40 kopií KIV2, což představuje celkem 13, 17, 33 a 49 kopií KIV. OxPL, oxidované fosfolipidy.
Fyziologická funkce Lp(a) ani apo(a) není známa. Uvažuje se o jeho účasti při reparaci a hojení ran, kdy by sloužil jako zdroj cholesterolu pro místo poranění. Lp(a) totiž prostřednictvím vazby na endotel a složky ECM zvyšuje místní ukládání cholesterolu v cévní stěně. Podílí se na atherosklerotickém postižení tepen a je spojen s tvorbou ATS plátu, ve kterém se hromadí. Lp(a) má vyšší atherogenní potenciál než LDL, protože kromě všech složek LDL obsahuje ještě apo(a), který různými mechanismy podporuje atherotrombosu. Apo(a) obsahuje oxidované fosfolipidy, které mohou spouštět prozánětlivé signální dráhy (indukují expresi prozánětlivých genů, uvolnění IL-8 a MCP-1 z monocytů). Lp(a) patří mezi pozitivní reaktanty akutní fáze, podporuje přeměnu makrofágů na pěnové buňky a proliferaci VSMCs, indukuje chemotaktickou aktivitu a produkci ROS v monocytech v subendotelovém prostoru. Navíc kompetuje s plasminogenem o vazebná místa na tPA a s plasminem o vazebná místa na fibrinových koagulech a tím zasahuje do procesu fibrinolýzy, protože snižuje množství aktivního plasminu a brání rozkladu fibrinových zátek. Také zvyšuje tvorbu a aktivitu PAI-1.
Plasmatické hladiny Lp(a) se mezi jedinci značně liší (řádově až 1000-násobně), ale u jednoho jedince jsou obvykle stálé. Mezi jednotlivými rasami existují rozdíly v koncentracích Lp(a), isoformách apo(a) a jednonukleotidových polymorfismech (SNP) genu LPA. Nejvyšší hladiny těchto parametrů byly nalezeny u černošské a nejnižší u východoasijské populace. Tyto hladiny jsou nezávislé na koncentraci jiných lipoproteinů a apolipoproteinů. Hladina Lp(a) je jen obtížně ovlivnitelná dietou a je z větší části (až 90 %) dána geneticky. Vyšší riziko ATS, kardiovaskulárních onemocnění, případně ischemického iktu je spojováno s koncentrací vyšší než 0,3 g/l (> 75 nmol/l). Terapeuticky je možné ovlivnit hladiny Lp(a) podáváním niacinu, který je snižuje až o 30 % v závislosti na podané dávce.
Homocystein
Homocystein je sirná aminokyselina, která je meziproduktem metabolismu methioninu a cysteinu (viz. Dědičné metabolické poruchy aminokyselin). Zvýšené hladiny homocysteinu jsou spojeny se zvýšeným výskytem atherosklerosou a trombosou podmíněných kardiovaskulárních chorob, s hyperkoagulačními stavy a tromboembolickou nemocí. Jsou prokazovány vztahy mezi hyperhomocysteinemií a arteriální hypertenzí, insulinovou rezistencí a dalšími onemocněními (např. Alzheimerova choroba), u těhotných je spojena s rizikem spontánních abortů, defektů uzavírání neurální trubice a rozštěpovými vadami páteře.
Homocystein způsobuje endotelovou dysfunkci jednak přímým působením na endotelové buňky, jednak zvýšením oxidačního stresu. Tato aminokyselina zasahuje i do metabolismu cholesterolu a lipidů, protože prostřednictvím aktivace transkripčního faktoru SREBP indukuje v buňkách endotelu transkripci a translaci HMG-CoA-reduktasy a tím zvyšuje syntézu a hromadění cholesterolu. V endotelových buňkách zvyšuje expresi genů pro adhezní molekuly, lipoproteinovou lipasu a LOX-1 a po jeho stimulaci oxLDL uvolnění TNF-α. Homocystein snižuje expresi transkripčních faktorů PPARα, které kontrolují metabolismus glukosy a lipidů. Dále zvyšuje proliferaci VSMCs, expresi proteinů ECM a adhezních molekul. Protrombotické působení homocysteinu je vyvoláno tím, že zvyšuje vazbu Lp(a) na fibrin, stimuluje v trombocytech tvorbu TxA2, aktivuje faktor V krevního srážení a interferuje s expresí trombomodulinu a prostacyklinu.
Fyziologické hladiny homocysteinu jsou v rozsahu 5-14,9 µmol/l, hladiny 15-30 µmol/l jsou označovány jako mírná, 31-100 µmol/l jako střední a nad 100 µmol/l jako těžká hyperhomocysteinemie. Hyperhomocysteinemie vzniká v důsledku zvýšené tvorby nebo sníženého odbourávání homocysteinu. Příčinami mohou být genetické defekty (např. deficit CBS, MTHFR či enzymů metabolismu kobalaminu – viz kapitola 14 – Dědičné poruchy metabolismu aminokyselin), nutriční či metabolické příčiny (např. karence kobalaminu, kyseliny listové, riboflavinu či hypovitaminosa pyrixoxinu) a chorobné stavy. Hladiny homocysteinu ovlivňují rovněž pohlaví, věk, rasové a etnické faktory a řada léčiv.
Infekce
O vztazích mezi ATS a různými infekcemi, například tyfem či spálou, se uvažovalo již od začátku 20. století. Mezi nejčastěji diskutované patogeny patří cytomegalovirus a Chlamydia pneumoniae. V ATS lézích byla prokázána přítomnost patogenů, ale k infekci ložiska pravděpodobně dochází sekundárně. V současnosti jsou diskutovány přímé (pronikání buněk, které prostřednictvím lokálních účinků urychlují růst plátu) a nepřímé (systémová exprese prozánětlivých cytokinů, které katalyzují vývoj plátu) mechanismy, kterými infekční agens přispívají k atherogenezi (Obr. 10). Infekční faktory se mohou podílet i na aktivaci autoimunitního procesu, který rovněž může zasáhnout do rozvoje ATS.
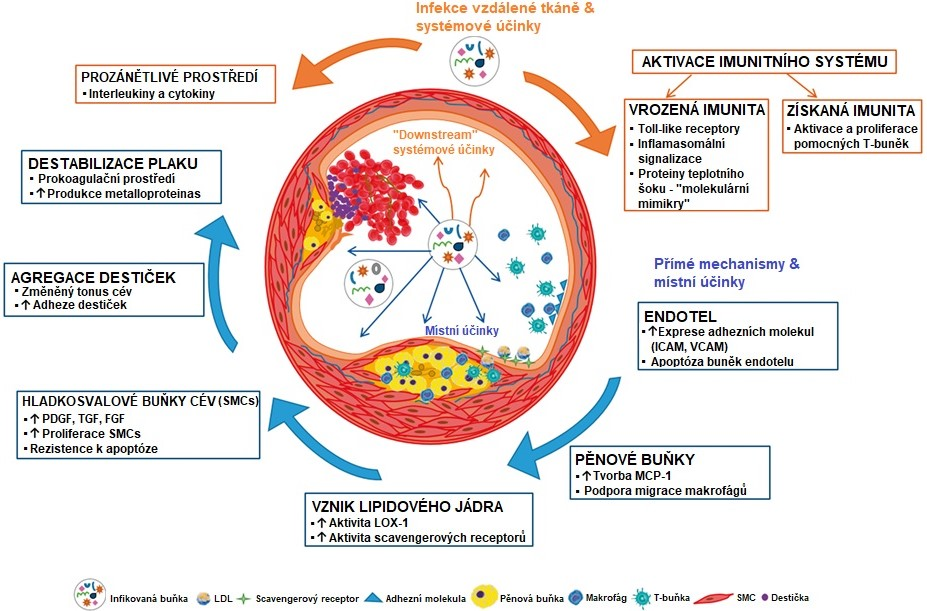
Obr. 10 Schematické zobrazení různých pro-atherosklerotických drah aktivovaných chronickou infekcí (upraveno z Pothineni et al. 2017). Modré šipky označují přímé účinky mikroorganismu na cévní endotel a oranžové šipky zobrazují systémové pro-atherosklerotické účinky.